共通テスト 第5問 問2
「 ついに出たっ! 」というか、「おいおい、これは掟破り、やっぱ反則だろ!!」という問題です。というのも、ハイレベル受験生にとっての壁の一つ、<チオ硫酸-ヨウ素滴定>(ヨードメトリー)の計算問題だからです。
とはいえ、体系化学アドバンス(AD)のテキストおよび授業では、Theme8,9の2回に渡って系統的・難易度に従って30問近くの演習するので、GHS生にとってはお馴染みです。
が、ふつうの多くの受験生にとってみれば、「これは何?」「意味がわからない?」と手付かず状態だったと思います。問題集には普通1-2問しかありませんので、かなり勉強している人でも手薄だったりします。
ましてこれは、還元剤のヨードメトリーですから、より難易度が高い立式となります。
もっとも、ADの難易度からすると、例題レベルであり、数値もキレイです。本格的には、SO2とH2Sの還元剤の混合ガスを滴定するのが「難問」の系譜なのですが、ここでは、H2Sだけで済ませています。つまり、「ADを薄めた」問題なのです。
「還元剤のヨードメトリー」だと見切ったら、フォーマットに従って、ささっと立式して、スイスイと解けばよいのですが、そもそもこれは、普通は国立二次試験や難関私立に出るエリアの問題ですから、一次試験で出すのはまさに「掟破り」です。「これからは、こういうのも遠慮せずに出すぞ!!」というお上(文科省)からの宣言と受け取っておきましょう。 どちらの問題かを見切りをするポイントは、
試料を ヨウ化カリウムと反応させている→ 相手は酸化剤
試料をヨウ素と反応させている → 相手は還元剤
です。そこで、計算フォーマットですが、


【体系化学ADによる解答】
I2 + 2e- → 2I–
+) H2S → S + 2e- + 2H+
————————————
I2 + H2S → S + 2HI
よって、H2SからI2への<物質量変換係数>はm=1です。あとは、未反応のI2をNa2S2OI3で滴定すればよく、(式が重目になるので、とりあえずH2Sはnmolとしておきます)
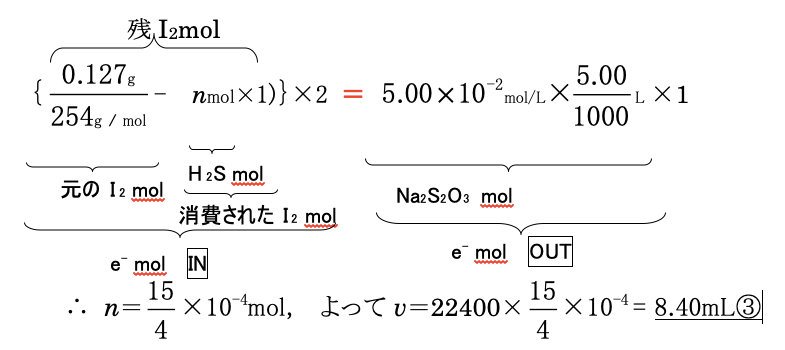
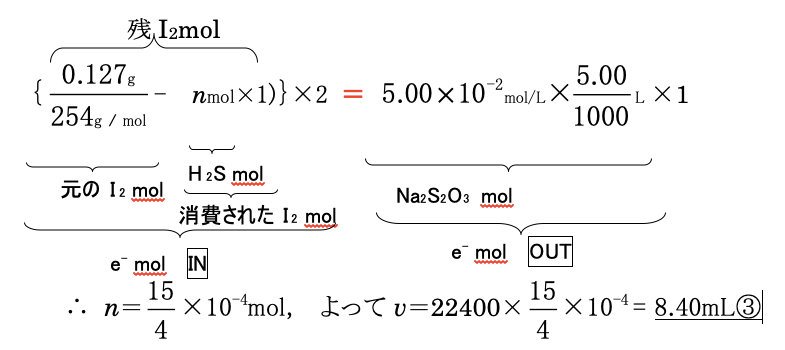
☞化学ADにおいては、このように立式は1行で済み、まさに‘一刀両断’です。ちなみに、問題文中にある4.80mLという数値は立式には不要です。実験操作中の事実を書いてあるだけです。が、これもヨードメトリーの実験操作についての基本的な知識をもつことで平然と「無視」できるものです。
体系化学ADのスキルを習得すれば、このような「難問」でも基本的に1行の立式で一刀両断できるようになります。同じように解けばよいだけだからです。解けない問題はないからです。
なぜできるのか? それは本当は「難問」など存在しないからであり、「難問」とは、遠回りに難しくといてある解答例と、本質を知らない受験生とが作り出す「幻想」に過ぎないからです。
それを可能にするのが、『体系化学』テキストで展開されている《化学計算原理》です。







